日本近期批准15分钟出结果新冠简易检测盒
2020/05/09
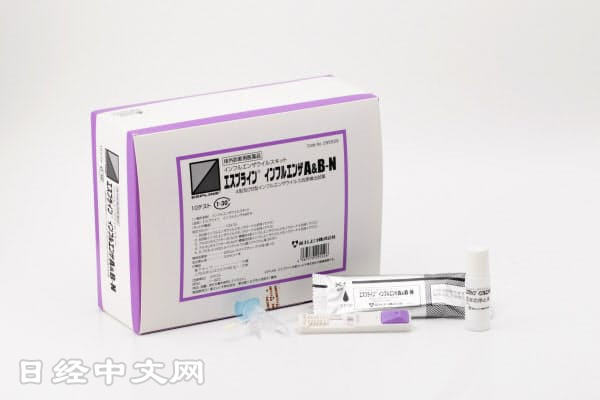
关于能进行新型冠状病毒简易诊断的“抗原检测”的检测试剂盒,日本Miraca控股(HD)的产品有望在日本国内首次获得实用化。日本厚生劳动省计划在下周内(5月11起的一周)给予药事批准。根据现行的PCR检测体制,从出现症状到确认呈阳性有时需要约1周时间,但Miraca的试剂盒可在15分钟内得出结果。虽然在准确度方面低于PCR检测,但作为前一阶段的检测被认为有效,如果获得批准,或将推动明显迟缓的日本的检测规模扩大。
 |
| 富士Rebio的流感抗原检测试剂盒。面向新型冠状病毒的抗原检测试剂盒也同样不需要专用设备,为一次性产品 |
Miraca的子公司富士Rebio(位于东京新宿区)4月27日向日本厚生劳动省申请获得制造销售许可。检测药的审批在日本通常需要数个月时间,但此次有望大幅缩短。日本首相安倍晋三和日本医学会也为增加检测人数而呼吁积极引进抗原检测。
抗原检测是通过被用于流感等诊断的方法来检测被称为“抗原”的病毒特有的蛋白质。其机制是采集鼻腔内的粘液,滴到试剂盒上,带有颜色的线将浮现。在医院等处,医生可当场在15分钟左右判断是否感染。最初,将在日本国内每周生产20万套,然后根据需求讨论扩大生产规模。
在纳入公共保险之前,能接受抗原检测的医疗机构可能仅限于一部分。另外,对于病毒量较少的感染初期的患者,与PCR检测相比,该检测的准确度较低。即使通过抗原检测诊断为未感染,如有疑似症状,也需要进一步接受PCR检测等。
目前用于新型冠状病毒的PCR检测需要熟悉专用设备和病毒处理的熟练检测员。难以在中小医疗机构等实施,这成为日本新冠病毒检测数增长缓慢的原因之一。如果抗原检测试剂盒得到实用化,有可能有助于检测体制的加强,这对于经济重启等新冠病毒应对举措的“退出战略”不可或缺。
除了此次的试剂盒外,富士Rebio还在开发需使用设备的新冠病毒抗原检测试剂。计划在6月底之前向日本厚生劳动省申请制造销售许可。
围绕新冠病毒的抗原检测试剂盒,日本中坚化学企业Denka也力争年内获得批准,正在加快开发。针对一次性试剂盒,计划6月之前完成试制品。2021年3月之前构建量产体制,每天最多量产10万套。
此外,荣研化学也开始讨论涉足新冠病毒的抗原检测。该公司销售因引发胃肠炎而广为人知的诺如病毒等的迅速检测试剂盒。针对新冠病毒,已推出基因检测用试剂。该公司社长和田守史表示“关于新型冠状病毒,在如今的感染高峰过去之后,如何有效使用抗原检测等方向性并未确定”,同时表示“如果出现必要性被充分认识到的状态,希望加以讨论”。
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
金融市场
| 日经225指数 | 28493.47 | 336.50 | 04/14 | close |
| 日经亚洲300i | 28493.47 | 336.50 | 04/14 | close |
| 美元/日元 | 132.42 | -0.60 | 04/14 | 15:15 |
| 美元/人民元 | 6.8381 | -0.0298 | 04/14 | 07:14 |
| 道琼斯指数 | 34029.69 | 383.19 | 04/13 | close |
| 富时100 | 7843.380 | 18.540 | 04/13 | close |
| 上海综合 | 3336.1530 | 17.7892 | 04/14 | 14:05 |
| 恒生指数 | 20405.12 | 60.64 | 04/14 | 14:04 |
| 纽约黄金 | 2041.3 | 30.4 | 04/13 | close |
・日本经济新闻社选取亚洲有力企业为对象,编制并发布了日经Asia300指数和日经Asia300i指数(Nikkei Asia300 Investable Index)。在2023年12月29日之后将停止编制并发布日经Asia300指数。日经中文网至今刊登日经Asia300指数,自2023年12月12日起改为刊登日经Asia300i指数。







