卫材的阿尔茨海默新药将在中日欧申请批准
2023/01/09
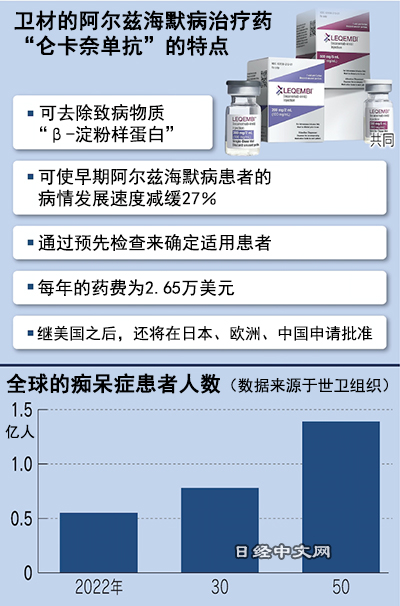
日本卫材(Eisai)1月7日发布消息称,该公司与美国渤健(Biogen)共同开发的阿尔茨海默症治疗药物获得了美国相关部门的快速批准,允许其作为药品使用。全球人口老龄化问题加剧,卫材首席执行官(CEO)内藤晴夫预测称,“到2030年,新药的适用患者将达到约250万人”。卫材打算继美国之后,在日本、欧洲、中国进行申请,力争在2023年度内获得批准。
美国食品药品监督管理局(FDA)6日快速批准了卫材和渤健开发的新药“仑卡奈单抗(Lecanemab)”。这款新药以早期阿尔茨海默症患者为对象,从脑部清除被认为是致病物质之一的蛋白质“β-淀粉样蛋白”的效果受到好评。
 |
内藤晴夫在接受日本经济新闻(中文版:日经中文网)的采访时表示,“未来3年,美国将有10万人使用这种药,能获得相当大的份额”。他还预测称,“包括中国和印度等国家在内,2030年全球将有250万名患者使用该药”,显示出今后积极扩大销售的态度。
全球的痴呆症患者被认为超过5000万人,预计到2030年将增加至约8000万人。阿尔茨海默症在痴呆症中的占比超过6成,随着病情的发展,患者会出现脑萎缩,丧失记忆和思考能力,最终难以正常生活。
这种病至今仍缺少治疗症状的药物。2021年由卫材和渤健共同开发的“阿杜那单抗(aducanumab)”为首款可长期抑制认知功能下降的药物,但由于临床试验数据不够充分,而且价格昂贵,最终未能普及。
仑卡奈单抗在最后阶段的临床试验中证明了可使阿尔茨海默症患者的症状恶化速度减缓27%的效果。每年的药费为2.65万美元,不到阿杜那单抗最初价格的一半。
新药普及有利于降低医疗和护理费用等,内藤表示“仅在美国就有相当于数百亿美元的社会价值”。
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
报道评论
金融市场
| 日经225指数 | 28493.47 | 336.50 | 04/14 | close |
| 日经亚洲300i | 28493.47 | 336.50 | 04/14 | close |
| 美元/日元 | 132.42 | -0.60 | 04/14 | 15:15 |
| 美元/人民元 | 6.8381 | -0.0298 | 04/14 | 07:14 |
| 道琼斯指数 | 34029.69 | 383.19 | 04/13 | close |
| 富时100 | 7843.380 | 18.540 | 04/13 | close |
| 上海综合 | 3336.1530 | 17.7892 | 04/14 | 14:05 |
| 恒生指数 | 20405.12 | 60.64 | 04/14 | 14:04 |
| 纽约黄金 | 2041.3 | 30.4 | 04/13 | close |
・日本经济新闻社选取亚洲有力企业为对象,编制并发布了日经Asia300指数和日经Asia300i指数(Nikkei Asia300 Investable Index)。在2023年12月29日之后将停止编制并发布日经Asia300指数。日经中文网至今刊登日经Asia300指数,自2023年12月12日起改为刊登日经Asia300i指数。







