全球疫苗开发加速,WHO提出50%有效目标
2020/07/22
全球正在加速开发新冠疫苗。英国药企阿斯利康(AstraZeneca)7月20日宣布,通过初期临床试验取得了强大的免疫反应。中美企业也将推进自主的疫苗临床试验。各公司均将2020年内实现疫苗实用化纳入视野,但也存在有效性低的可能性,仍然存在疫苗供给的课题。
“关于向日本供应疫苗,正在与日本政府就1亿剂疫苗展开谈判”。20日,阿斯利康的首席执行官(CEO)帕斯卡尔·索里奥特对供给体制显示出自信。原因是在4月启动的临床试验中,发现了一定的预防效果。
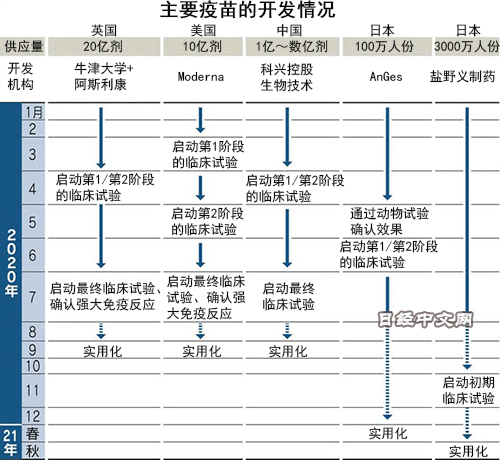 |
世界卫生组织(WHO)的统计显示,除了阿斯利康的疫苗之外,美国Moderna、德国BioNTech、日本AnGes等的24种候选疫苗的临床试验在各国推进。通常的疫苗从启动开发到结束临床试验需要3~5年,但目前很多制药商将这一时间缩短为半年左右,竞争日益激烈。
此外,各国的支持也是开发速度加快的原因。美国将推进被特朗普总统命名为“曲率极速行动(Operation Warp Speed)”的官民计划,这是向疫苗开发和量产提供补贴的机制。受此推动,强生(J&J)将临床试验计划从当初的2021年上半年大幅提前至2020年9月。
在中国,康希诺生物、科兴控股生物技术、国药控股等获得政府的全面支持,在临床试验和供给两方面加快推进。
课题是疫苗是否实际有效。在疫苗的世界里,如果有效性为50%,那么10人中的5人将在接种后仍会发病。70%则是3人,数字越高,越有效果。如果是一般疫苗,有效性达到8成以上,但世卫组织考虑到全球性大流行,针对新冠疫苗,将要求的大致标准定为50%。
已发布临床试验结果的企业并未透露有效性。日本药企第一三共的常务执行董事籔田雅之表示,“被要求以罕见的速度推进开发,即使是50%也面临巨大障碍”。
美国国家过敏与传染病研究所所长安东尼·福奇在美国有线电视新闻网(CNN)的节目中表示,“要遏制新冠病毒,需要70~75%的有效性”,给开发和增产的“赶工”情况浇了冷水。
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
报道评论







