全球新药研发在向中国集结
2019/08/21
日美欧制药企业开始构建在中国的研究开发体制。法国赛诺菲、日本盐野义制药等将利用中国超过13亿人口的医疗相关数据,研发疑难病以及在亚洲多发的消化器官疾病等的治疗药物。由于中国政府不断完善临床试验和专利制度,已经出现比欧美还早获批的新药上市。曾经被定位于低成本生产基地的中国也将进入制药厂商等开始集结研发职能的新局面。
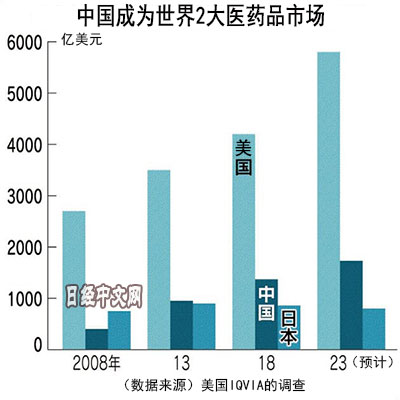
据美国调查公司IQVIA统计,中国医疗市场持续扩大,其中药品市场2018年达到1370亿美元,达到2008年的3.4倍。超过日本,继美国之后排名世界第二。预计到2023年将达到1700亿美元。
药企在中国加强研发职能
围绕中美贸易战,对中国的知识产权保护的担忧在扩大,但医药品并未成为中美间争夺的焦点。中国进口的美国医药品也被排除在制裁关税对象之外。由于中国的人工费上涨,作为廉价生产基地的优势越来越小,在这一背景下,各药企也着眼加强在当地的研发职能。
 |
赛诺菲在四川省成都市设置了亚洲首个研发基地。在利用大数据分析的同时,将投资6600万欧元,广泛研究糖尿病及自身免疫疾病等。
中国人口众多,便于对一些在日本比较罕见的病症患者和疑难杂症患者集中开展临床试验。目前,在欧美盛行一种被称为药物重定位(Drug repositioning,或称“老药新用”)的研究,具体指寻找已有药物在适应症状以外的治疗效果的可能性的研究。这类研究也将在中国得以全面开展。
美国辉瑞制药将仿制药部门从业务中剥离,5月在上海开设了全球统括总部。其目的是积累和储备患者数量趋势和副作用等数据库。盐野义则打算构建部分新药比起日美欧优先在中国研发的体制。该公司正在当地收集结核治疗药临床试验开始前的有效性和安全性等数据。
背景是中国政府积极吸引外资企业的政策。2017年,中国加入制定日美欧质量管理标准的国际组织。和日美欧一样提出了新药质量管理和保护专利的方针。为了能利用国外的临床试验数据,还放宽限制,启动扩充审查人员优先审查创新性医药品的制度。药品获批上市的时间因此缩短了1~2年。
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
报道评论
金融市场
| 日经225指数 | 28493.47 | 336.50 | 04/14 | close |
| 日经亚洲300i | 28493.47 | 336.50 | 04/14 | close |
| 美元/日元 | 132.42 | -0.60 | 04/14 | 15:15 |
| 美元/人民元 | 6.8381 | -0.0298 | 04/14 | 07:14 |
| 道琼斯指数 | 34029.69 | 383.19 | 04/13 | close |
| 富时100 | 7843.380 | 18.540 | 04/13 | close |
| 上海综合 | 3336.1530 | 17.7892 | 04/14 | 14:05 |
| 恒生指数 | 20405.12 | 60.64 | 04/14 | 14:04 |
| 纽约黄金 | 2041.3 | 30.4 | 04/13 | close |
・日本经济新闻社选取亚洲有力企业为对象,编制并发布了日经Asia300指数和日经Asia300i指数(Nikkei Asia300 Investable Index)。在2023年12月29日之后将停止编制并发布日经Asia300指数。日经中文网至今刊登日经Asia300指数,自2023年12月12日起改为刊登日经Asia300i指数。







