猪给人类提供移植脏器的时代或将来临
2016/06/16
作为缓解脏器不足的手段,将猪等动物的细胞和组织移植到人类身上的“异种移植”备受关注。此前因受防止传染病的指导方针限制,日本事实上无法实施异体移植,不过日本厚生劳动省的研究组5月27日放宽了异种移植的指导方针。预计3~5年后日本的国立国际医疗研究中心和福冈大学等将实现把使用猪胰脏细胞的人工合成胶囊移植到1型糖尿病患者身上的临床研究。
将猪细胞“人工胰岛”移植到糖尿病患者身上
日本厚生劳动省近期通告各医疗机构修订过的异种移植指导方针。实施异种移植再生医疗临床研究的情况下,研究者经过在实施机构中设置的审查委员会的审议,听取“特定认定再生医疗等委员会”的意见,并向厚生劳动省提交异种移植的再生医疗计划。厚生劳动相在听取厚生科学审议会的意见,确认安全性的基础上批准实施临床研究,这是日本首次启动异种移植的临床研究。
日本首次实施的异种移植被认为将是向1型糖尿病患者移植猪的胰岛。1型糖尿病患者胰脏内的胰岛因免疫等原因受损,从而无法分泌降低血糖值的胰岛素。从儿童到青年,发病率很高。现在的治疗方法是将脑死亡者的胰脏和胰岛移植到患者身上,但是需要使用免疫抑制剂,另外供体也严重短缺。据推算日本国内的1型糖尿病患者数量在7~10万人。其中,据称有超过100人在等待移植胰脏和胰岛。为了解决供体不足问题,开发了用半透明膜包裹猪胰岛细胞的“生物人工胰岛”。
新西兰已启动临床试验
该胶囊可以通过胰岛素和胰岛生存所必须的营养物质,但炎症物质却无法通过。因此,移植后即使不使用免疫抑制剂也可以抑制排斥反应。新西兰的创业企业Living Cell Technologies已经在新西兰实施将生物人工胰岛移植到患者腹中的临床试验。
临床试验报告显示,虽然没有完全无需注射胰岛素的患者,但是胰岛素的使用量有所减少,此外1~2个月的血糖值的平均值血红素A1c的值也出现下降。此外低血糖的发作也出现减少。
日本的国立国际医疗研究中心的胰岛移植项目组长霜田雅之表示“将建设胰岛移植用猪的饲养设施,力争3~5年后实施临床试验”。福冈大学医院再生医疗中心的小玉正太主任教授也表示“将推进筹备工作,力争3年后启动临床试验”。今后,很可能在日本的多家医疗机构实施猪的胰岛移植临床试验。
1型糖尿病患者和家人的支援团体—NPO法人“日本IDDM网络(佐贺市)”希望借助生物人工胰岛移植根治1型糖尿病,正在筹集资金以支持此类研究。
60年代曾进行黑猩猩和狒狒的脏器移植
脑死亡者的脏器移植在欧美得到广泛实施,但即使是在比日本提供者更多的欧美,脏器不足都日趋成为严重问题。据称在世界范围内,超过10万名患者正等待移植。作为解决这种脏器不足的措施之一,被寄予厚望的是异种移植。
首先在1960年代,接近于人类的黑猩猩和狒狒的肝脏、肾脏及心脏移植得到实施。但是,患者因排异反应而死亡。
进入80年代后,作为脏器提供动物,猪开始受到关注。其原因包括猪的脏器大小和生理功能类似于人类,而且在家畜中,微生物污染较少,饲养头数多。由于狒狒感染了对人类具有危险性的各种病毒,同时供给数量有限等原因,猪的受关注度开始提高。
培育植入减轻排异反应的基因的猪
在猪的脏器移植中,移植后数分钟出现的超急性排异反应成为课题。1992年植入减轻超急性排异反应的基因的猪被培育出来,1995年获得了这头猪的心脏在猴子体内存活60天以上的结果。
受海外异种移植研究趋势的推动,日本厚生劳动省的研究团队2002年制定了旨在防止异种移植导致的传染病的指导方针。这是因为如果将动物细胞等移植到人体内,有可能感染克罗伊茨费尔特-雅各布布病((Creutzfeldt-Jakob disease, CJD))等。
在这一指导方针中,列出了应排除从猪到人感染危险性的病原体的名单。在纳入这一名单中的病原体中,无论如何难以排除的是有可能发展为癌症的逆转录病毒(Retrovirus)。
逆转录病毒的基因在猪进化的过程中被嵌入基因组。因此,进行检查时,必定产生阳性反应,采用猪细胞和组织的异种移植此前在日本并未实际实施。
采用动物细胞的再生医疗2014年在日本合法化
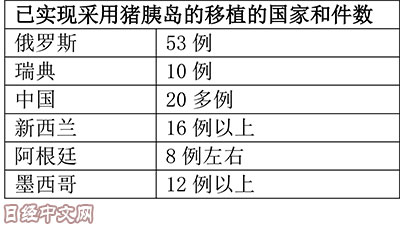
不过,据称这个病毒的基因在猪的体内沉睡着。国际异种移植协会2009年发布了旨在推动异种胰岛移植的统一见解。随后,Living Cell Technologies公司在新西兰、阿根廷和俄罗斯,启动了将包含猪胰岛细胞的胶囊植入1型糖尿病患者体内的临床试验。
而在日本,随着2014年11月实行再生医疗等安全性确保法,此前定位并不明确的采用动物细胞的再生医疗可以合法实施。随着这部法律的施行,移植猪胰岛的临床研究浮出水面。日本厚生劳动省的研究团队将焦点对准猪胰岛移植,修订了指导方针。
在修订后的指导方针中,逆转录病毒仍留在“应排除的病原菌名单”之中。不过,在过去35年里,从猪到人类的异种移植实施了200例以上,但并未出现感染逆转录病毒的病例报告,因此通过尽可能抑制科学上的风险,为实施开辟了道路。
被嵌入猪基因组的逆转录病毒的基因数量有所不同。因此,列举了尽可能降低风险的条件,例如尽可能选择逆转录病毒基因数少的猪、以及一起培养猪和人类细胞、病毒不得在人类细胞中检出等。此外,接受移植的患者需要终生进行定期检查。此外,还规定猪的血清试样和移植记录保存30年。
讨论移植猪的心脏和肝脏
在胰岛之后,作为脑死后提供脏器得以实现之前的过渡举措,还正在讨论移植猪的心脏和肝脏等。2016年4月,美国国家心肺血液研究所宣布,将猪的心脏移植到狒狒体内,猪的心脏在狒狒体内正常跳动长达945天(约2年半)。
减轻向人类移植时成为最大课题的排异反应的猪的培育在日本鹿儿岛大学、明治大学和农业与食品产业技术综合研究机构等正在推进。此外,向免疫不全的猪移植人类的干细胞、在猪体内培养类人脏器这一研究也在推进。
日本经济新闻(中文版:日经中文网)科学技术部 西山彰彦
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
将猪细胞“人工胰岛”移植到糖尿病患者身上
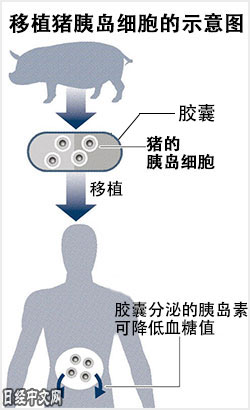 |
日本首次实施的异种移植被认为将是向1型糖尿病患者移植猪的胰岛。1型糖尿病患者胰脏内的胰岛因免疫等原因受损,从而无法分泌降低血糖值的胰岛素。从儿童到青年,发病率很高。现在的治疗方法是将脑死亡者的胰脏和胰岛移植到患者身上,但是需要使用免疫抑制剂,另外供体也严重短缺。据推算日本国内的1型糖尿病患者数量在7~10万人。其中,据称有超过100人在等待移植胰脏和胰岛。为了解决供体不足问题,开发了用半透明膜包裹猪胰岛细胞的“生物人工胰岛”。
新西兰已启动临床试验
该胶囊可以通过胰岛素和胰岛生存所必须的营养物质,但炎症物质却无法通过。因此,移植后即使不使用免疫抑制剂也可以抑制排斥反应。新西兰的创业企业Living Cell Technologies已经在新西兰实施将生物人工胰岛移植到患者腹中的临床试验。
临床试验报告显示,虽然没有完全无需注射胰岛素的患者,但是胰岛素的使用量有所减少,此外1~2个月的血糖值的平均值血红素A1c的值也出现下降。此外低血糖的发作也出现减少。
日本的国立国际医疗研究中心的胰岛移植项目组长霜田雅之表示“将建设胰岛移植用猪的饲养设施,力争3~5年后实施临床试验”。福冈大学医院再生医疗中心的小玉正太主任教授也表示“将推进筹备工作,力争3年后启动临床试验”。今后,很可能在日本的多家医疗机构实施猪的胰岛移植临床试验。
1型糖尿病患者和家人的支援团体—NPO法人“日本IDDM网络(佐贺市)”希望借助生物人工胰岛移植根治1型糖尿病,正在筹集资金以支持此类研究。
60年代曾进行黑猩猩和狒狒的脏器移植
脑死亡者的脏器移植在欧美得到广泛实施,但即使是在比日本提供者更多的欧美,脏器不足都日趋成为严重问题。据称在世界范围内,超过10万名患者正等待移植。作为解决这种脏器不足的措施之一,被寄予厚望的是异种移植。
首先在1960年代,接近于人类的黑猩猩和狒狒的肝脏、肾脏及心脏移植得到实施。但是,患者因排异反应而死亡。
进入80年代后,作为脏器提供动物,猪开始受到关注。其原因包括猪的脏器大小和生理功能类似于人类,而且在家畜中,微生物污染较少,饲养头数多。由于狒狒感染了对人类具有危险性的各种病毒,同时供给数量有限等原因,猪的受关注度开始提高。
培育植入减轻排异反应的基因的猪
在猪的脏器移植中,移植后数分钟出现的超急性排异反应成为课题。1992年植入减轻超急性排异反应的基因的猪被培育出来,1995年获得了这头猪的心脏在猴子体内存活60天以上的结果。
 |
| 通过转基因消除免疫功能的免疫不全的克隆猪(农研机构提供) |
在这一指导方针中,列出了应排除从猪到人感染危险性的病原体的名单。在纳入这一名单中的病原体中,无论如何难以排除的是有可能发展为癌症的逆转录病毒(Retrovirus)。
逆转录病毒的基因在猪进化的过程中被嵌入基因组。因此,进行检查时,必定产生阳性反应,采用猪细胞和组织的异种移植此前在日本并未实际实施。
采用动物细胞的再生医疗2014年在日本合法化
不过,据称这个病毒的基因在猪的体内沉睡着。国际异种移植协会2009年发布了旨在推动异种胰岛移植的统一见解。随后,Living Cell Technologies公司在新西兰、阿根廷和俄罗斯,启动了将包含猪胰岛细胞的胶囊植入1型糖尿病患者体内的临床试验。
而在日本,随着2014年11月实行再生医疗等安全性确保法,此前定位并不明确的采用动物细胞的再生医疗可以合法实施。随着这部法律的施行,移植猪胰岛的临床研究浮出水面。日本厚生劳动省的研究团队将焦点对准猪胰岛移植,修订了指导方针。
 |
被嵌入猪基因组的逆转录病毒的基因数量有所不同。因此,列举了尽可能降低风险的条件,例如尽可能选择逆转录病毒基因数少的猪、以及一起培养猪和人类细胞、病毒不得在人类细胞中检出等。此外,接受移植的患者需要终生进行定期检查。此外,还规定猪的血清试样和移植记录保存30年。
讨论移植猪的心脏和肝脏
在胰岛之后,作为脑死后提供脏器得以实现之前的过渡举措,还正在讨论移植猪的心脏和肝脏等。2016年4月,美国国家心肺血液研究所宣布,将猪的心脏移植到狒狒体内,猪的心脏在狒狒体内正常跳动长达945天(约2年半)。
减轻向人类移植时成为最大课题的排异反应的猪的培育在日本鹿儿岛大学、明治大学和农业与食品产业技术综合研究机构等正在推进。此外,向免疫不全的猪移植人类的干细胞、在猪体内培养类人脏器这一研究也在推进。
日本经济新闻(中文版:日经中文网)科学技术部 西山彰彦
版权声明:日本经济新闻社版权所有,未经授权不得转载或部分复制,违者必究。
